Irrancidimento Ossidativo: Iniziazione e Propagazione
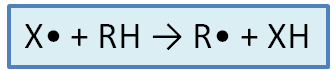
Supposto che:
- RH= acido grasso idrogenato
- X• = radicale libero
- O2 = ossigeno
si ha che la reazione di iniziazione è verificata dall’equazione:
dove R• = grasso ossidato e XH = molecola stabile (non reattiva)
La reazione di iniziazione origina un numero limitato di molecole di acidi grassi dotate di un elettrone spaiato R• che sono molto reattive a loro volta nei confronti di altre molecole sensibili: siamo nel secondo stadio.
La propagazione è un sistema complesso di reazioni cicliche che seguono uno schema “inflazionario” e da una serie ne scaturiscono altre fino a raggiungere un plateu oltre cui la materia reagente termina.
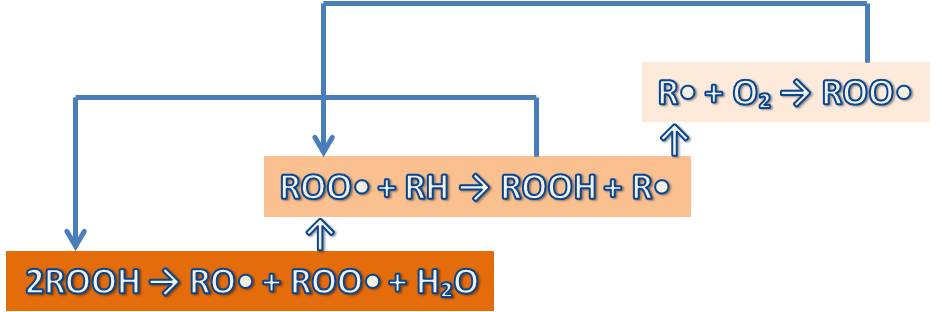
Propagazione di Reazioni Ossidative; Lo schema va letto dall’alto verso il basso, le frecce indicano reazioni a catena
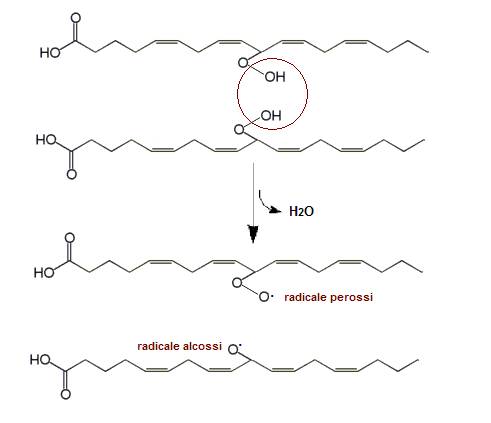
Nelle reazioni di propagazione l’ossigeno atmosferico reagisce con i radicali liberi per dare radicali perossi (ROO•) anche essi molto instabili. Se incontrano un acido grasso insaturo (RH) nelle vicinanze, formano insieme un idroperossido (ROOH) e un nuovo radicale reattivo (R•). Due idroperossidi reagendo tra loro formano acqua, radicali perossi (ROO•) e radicali alcossi (RO•).
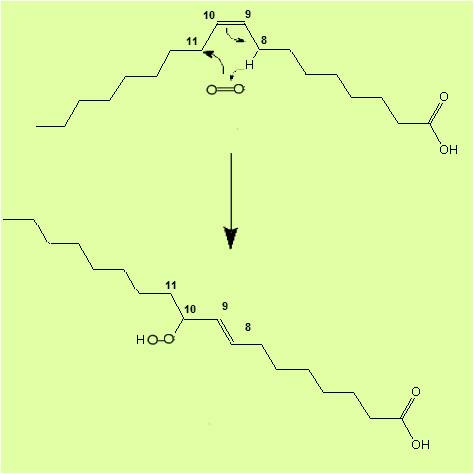
I radicali perossi e alcossi sono nuovamente implicati in una nuova serie di reazioni radicaliche. In effetti essi, come il radicale originario del primo stadio, sono capaci di estrarre facilmente gli atomi di idrogeno dei gruppi metilenci dei grassi monoenoici (acido oleico) e dei polienoici (come l’acido linoleico). I gruppi metilenici sono particolarmente esposti all’estrazione idrogenionica e da cui l’elettrone rimasto tende a spostarsi sulla catena carboniosa per formare un doppio legame trans assieme ad un idroperossido. Questo meccanismo interessa in particolare l’acido oleico (C18:1) e dà origine agli idroperossidi in posizione 8-9-10 e 11 in percentuali uguali. La reazione dell’acido linoleico (C18:2) invece porta alla formazione di idroperossidi in posizione 9 e 13 in quanto il diene coniugato è molto stabile e difficilmente concede l’ingresso all’ossigeno nelle parti centrali del sistema elettronico. Man mano che gli idroperossidi si accumulano nel grasso, l’ossigeno disciolto nella matrice grassa è assorbito in quantità notevoli ma, al procedere della reazione a catena, iniziano sempre più ad evidenziarsi i prodotti della degradazione come aldeidi, chetoni e alcoli. A generare tutte queste reazioni a cascata sembra essere implicato l’ossigeno singoletto ovvero una forma di ossigeno molto instabile (di cui parlo in altra sede), e che sembra essere attivato dalla clorofilla, dal gruppo eme (nella carne), dalla riboflavina e dalla luce. Non a caso gli oli tendono a conservarsi per un tempo più lungo se sono disposti in recipienti scuri, schermati dalla radiazione luminosa ed in cui sia stata applicata una bassa una bassa pressione parziale di ossigeno ( ovvero in atmosfera modificata).